E-learning 2. Analýza dat 2.3. Analýza vysokohustotních proteomických dat 2.3.2. Hmotnostní spektrometrie 2.3.2.1. Úvod
2.3.2.1.1 Co je proteomika?
Proteiny jsou sloučeniny vytvořené pomocí řetězce aminokyselin ve 3-rozměrné struktuře, která uskutečňuje biologické funkce. Sekvence aminokyselin je určena pomocí DNA skrz transkripci do přenosové RNA (mRNA). Proteom je soubor všech proteinů exprimovaných buňkou a proteomika je studium proteomů.
Existuje několik faktorů, které proteomiku odlišují od studia variace dědičné genetiky. Exprese proteinů je specifická pro buňku a čas, a tak se může u jednotlivce měnit.
Od dědičné DNA k onemocnění vede mnoho kroků, včetně transkripce do RNA, translace do proteinů a post-translačních úprav. Jednou z motivací pro studium proteomu v klinickém prostředí je skutečnost, že je v jistém smyslu k průběhu onemocnění bližší.
2.3.2.1.2 Hmotnostní spektrometrie
Je-li hmotnostní spektrometrie (MS) použita na vhodný biologický vzorek (plasma, sérum, atd.), může být použita k charakterizování proteomu. Před MA je aplikováno mnoho experimentálních kroků předzpracování, včetně odstranění přebytečných proteinů, které by jinak v profilu převažovaly, frakcinace, digesce a separace. Tyto kroky zde nejsou dál probírány. Používají se různé typy MS analyzérů; zde se zaměříme na MS založenou na time-of-flight (TOF), zvláště Matrix-assisted laser desorption-ionisation (MALDI)-TOF a Surface-enhanced laser desorption-ionisation (SELDI)-TOF. Biologický vzorek se aplikuje na čip. MALDI používá energii-absorbující matrix, která usnadňuje ionizaci bez velké fragmentace. SELDI má podobný princip jako MALDI, ale čipy jsou přetřeny speciálním chromatografickým povrchem, takže se na povrch váží různé proteiny v závislosti na svých chemických vlastnostech a vlastnostech čipu.
MS využívá skutečnosti, že molekuly (včetně peptidů a proteinů) mají různé hmotnosti. Po použití urychlení elektrického pole se ionizované molekuly pohybují dolů po délce MS přístroje k „detektoru“, který měří TOF a abundanci; získaný čas závisí na jejich hmotnosti, nebo přesněji jejich podílu hmotnosti s nábojem (mass-to-charge = m/z). TOF lze převést do m/z měřítka měřeného v Daltonech. Typicky se zvažovaný rozsah pohybuje mezi 2000 až 50000 Daltonů, jelikož je zpravidla v nižších rozmezích příliš mnoho šumu, i když je to strojově závislé a výkon je neustále vylepšován.
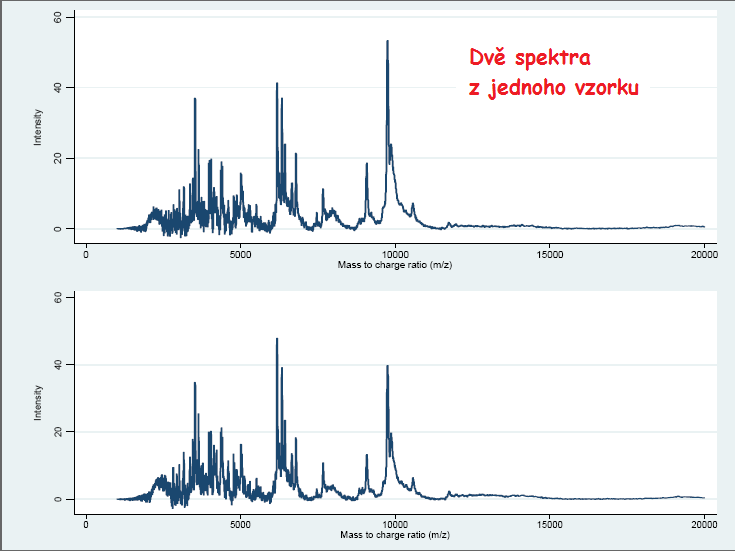
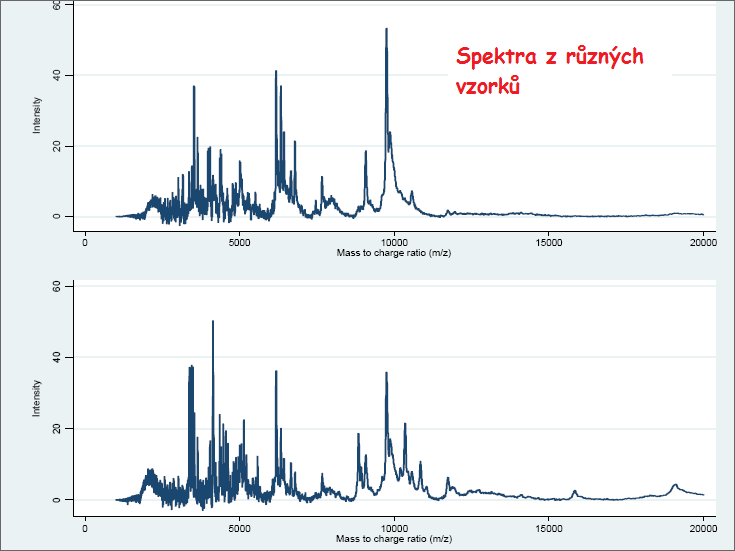
MS se na biologický vzorek používá, aby změřila výsledky proteomického profilu v sadě datových bodů (x, y) ve dvou rozměrech, kde x je m/z hodnota a y je míra abundance. Další analýza, kterou lze provést, vede k rozpoznání proteinů odpovídajících m/z hodnotám. V mnoha případech jsou přesto identity odpovídajících proteinů neznámé, a samotné profily se používají k rozlišení mezi různými skupinami biologických vzorků. Zde se zaměříme na analýzu takových dat v kontextu „bez označení“ („label-free“), důležitý krok rozpoznávání peptidů a proteinů nezůstane utajen. Příklady výsledného spektra lze vidět v doprovázejících obrázcích (obrázek 2.3.2.1 a obrázek 2.3.2.2).
Obrázek 2.3.2.1 Příklad dvou spekter z jednoho totožného vzorku
Obrázek 2.3.2.2 Příklad spekter ze dvou rozdílných vzorků